Nuovo ruolo della lamina A/C nella risposta allo stress meccanico
Una ricerca condotta presso i laboratori dell’IGM sezione di Bologna, ha identificato una nuova funzione della lamina A/C, una proteina presente nella lamina nucleare, le cui mutazioni a livello genico danno origine un gruppo eterogeneo di patologie che prendono in nome di laminopatie.
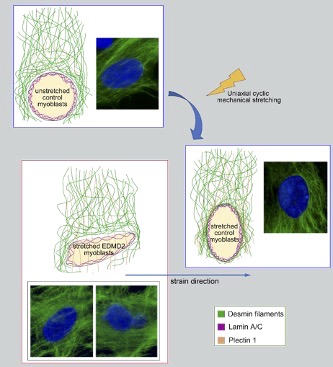
La lamina A/C ha diverse funzioni all’interno della cellula tra cui anche quella di partecipare alla meccanotrasduzione del segnale che dalla superficie cellulare arriva al nucleo e viceversa. La meccanotrasduzione del segnale consiste nella capacità delle cellule di rispondere ad uno stimolo meccanico attivando segnali intracellulari, risposte metaboliche e regolando la loro morfologia e architettura. Questo processo è di fondamentale importanza nelle cellule muscolari, in grado di rispondere allo stress meccanico attraverso una riorganizzazione delle strutture citoscheletriche e il riposizionamento dei nuclei. Tra i principali attori della meccanotrasduzione del segnale nelle cellule muscolari, oltre alla lamina A/C, vi è un gruppo di proteine che si localizza a livello dell’involucro nucleare e che prende il nome di complesso LINC (Linker of Nucleoskeleton and Cytoskeleton). I principali costituenti del complesso LINC sono rappresentati da emerina, dalle nesprine e dalle proteine SUN, che trasferiscono l’informazione meccanica sia verso la porzione citoplasmatica, interagendo con proteine del citoscheletro quali desmina, tubulina e actina; sia verso la porzione nucleare, la maggior parte di queste proteine è infatti in grado di interagire con la lamina A/C, che agisce da meccanosensore trasferendo le informazioni esterne alla cromatina. Di notevole interesse è il fatto che mutazioni a carico dei geni che codificano per le proteine del complesso LINC e per la lamina A/C, sono responsabili di un fenotipo patologico comune, una distrofia muscolare che prende il nome di distrofia muscolare di Emery-Dreifuss, caratterizzata da debolezza e atrofia muscolare, da contratture articolari precoci e da cardiomiopatia.
Durante questo studio è stato scoperto che, nelle cellule muscolari sottoposte a stimolazione meccanica mediante un bioreattore, la lamina A/C è coinvolta nella riorganizzazione delle proteine citoscheletriche a livello della superficie nucleare. Abbiamo infatti osservato, che nelle cellule muscolari umane sia desmina che plectina sono in grado di legare la lamina A/C in seguito a stress meccanico e tramite essa sono reclutate a livello della superficie nucleare, in un evento probabilmente mediato anche dalle proteine del complesso LINC. E’ dimostrato inoltre, che questo tipo di risposta allo stress meccanico è alterata nei mioblasti con mutazioni sul gene che codifica per la lamina A/C, nei quali abbiamo osservato anche difetti nel riposizionamento del nucleo in seguito a stress.
I risultati ottenuti in questo lavoro sono rilevanti al fine di comprendere i meccanismi molecolari che determinano l’insorgenza dei difetti muscolo scheletrici che caratterizzano la distrofia di Emery-Dreifuss.
Questa ricerca è stata realizzata grazie al contributo dell’associazione italiana distrofia muscolare di Emery-Dreifuss (AIDMED) e dell’associazione italiana Alessandra Proietti, che ringraziamo per il loro supporto. Questi studi sono stati inoltre finanziati del piano nazionale di ripresa e resilienza (PNRR) progetto ECOSISTER , dal CNR progetto Nutr-Age e dell’Agenzia Italiana del Farmaco (AIFA) progetto TREAT-LMNA.