Phosphorylation-mediate control of RNA editing by AKT in tumorigenesis and cancer progression
L’insorgenza e poi la progressione tumorale sono spesso dovuti a mutazioni nelle vie di trasduzione del segnale che regolano la crescita e la proliferazione cellulare. Le proteine associate a queste vie di segnale rappresentano quindi potenziali oncogeni o oncosoppressori. La maggior parte dei tumori, dall’insorgenza ai vari stadi di progressione, presentano come caratteristiche distintive l’instabilità genomica, mutazioni somatiche, alterazioni epigenetiche e modificazioni del trascrittoma. Uno dei processi che può alterare notevolmente il trascrittoma è l’editing dell’RNA, che consiste nella conversione di una adenosina in inosina (A-to-I) nell’RNA a doppio filamento; questo processo è catalizzato da enzimi definiti “deaminasi che agiscono sull’RNA” (ADARs). L’editing dell’RNA provoca un cambiamento dei codoni dopo la trascrizione, producendo trascritti che differiscono per una singola base azotata, ma che possono dare origine ad un’enorma variabilità del proteoma, a difetti dello sviluppo cellulare ed infine possono aumentare le probabilità di carcinogenesi (Xu LD et al., 2018). Questi aspetti dell’editing dell’RNA, e come essi siano regolati, sono ancora poco studiati.
L’editing dell’RNA è una modificazione fondamentale a carico dell’RNA che determina cambiamenti nucleotidici che sfuggono al controllo della regolazione genetica. Le cellule di mammifero esprimono tre isoforme di deaminasi, ADAR1, ADAR2 and ADAR3; di queste, ADAR3 non presenta attività deaminasica.
Alterazioni nel meccanismo di editing dell’RNA sono state riportate in diverse tipologie tumorali, quali il carcinoma epatocellulare, la leucemia mieloide cronica, il mieloma multiplo e il glioblastoma. Nei tumori, ADAR1 è solitamente up-regolato e supporta la crescita e la sopravvivenza cellulare modificando l’mRNA e miRNA coinvolti nella progressione tumorale; in altri studi, è stato riportato che ADAR1 funzioni come oncosoppressore. L’attività di editing di ADAR2, invece, inibisce la crescita tumorale.
Recentemente, il nostro gruppo ha dimostrato un ruolo della famiglia di protein chinasi AKT nella regolazione dell’editing dell’RNA (Piazzi et al., 2020; Bavelloni et al., 2019): la chinasi AKT nella sua forma attiva, fosforila ADAR1 e ADAR2 su un residuo di treonina conservato, nel dominio catalico, e su ulteriori 4 siti (Fig.1). L’espressione di un mutante di ADAR1 e ADAR2 che imitasse la fosforilazione costitutiva sulla treonina conservata (TàD), ha determinato una riduzione dell’attività deaminasica su diversi substrati noti.Pertanto, la fosforilazione di ADAR1 e ADAR2, mediata da AKT, può rappresentare un collegamento diretto tra l’attivazione incontrollata della via PI3K-AKT-mTOR, presente in numerosi tumori, alla variabilità trascrittomica e alle alterazioni nello splicing alternativo.
L’obiettivo di questo progetto è definire se l’attivazione di AKT sia direttamente associata alle alterazioni dello splicing alternativo presenti in molti tumori, e se la regolazione farmacologica dell’asse AKT-ADAR possa rappresentare una nuova strategia per migliorare la risposta terapeutica.
Il nostro Laboratorio si pone di rispondere ai quesiti seguenti:
- Quali effetti ha lo stato di attivazione di AKT sull’espressione di ADAR1 e ADAR2?
- Quali effetti la fosforilazione di AKT su ADAR1 e ADAR2, provoca sull’editing e sullo splicing cellulare?
- Che ruolo la fosforilazione di AKT su ADAR1 e ADAR2, determina sull’insorgenza dei tumori?
- Che ruolo la fosforilazione di AKT su ADAR1 e ADAR2, determina sulla risposta terapeutica?
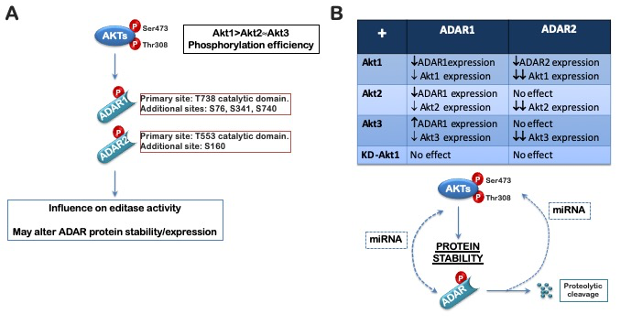 |
Figure 1. Schematic diagram of AKT-dependent regulation of ADAR1 and ADAR2. (A) All three AKT isoforms phosphorylate both ADAR1p110 and ADAR2. Four sites were found to be phosphorylated by AKT1 in ADAR1p110 (S76, S341, T738, S740), with the major phosphorylation
site being T738; two sites were found to be phosphorylated by AKT1 in ADAR2 (S160 and T553), with the major phosphorylated site being T553. (B) Active AKT and the ADARs may co-regulate one another. The exact mechanism has not been defined, but AKT might influence ADAR1p110 and ADAR2 protein stability or ADAR. |
Bibliografia:
Xu LD and Ohman M. ADAR1 editing and its role in cancer. (2018). Genes (Basel). 25;10(1):12.
Piazzi M, Bavelloni A, Gallo A, Blalock WL. AKT-Dependent Phosphorylation of ADAR1p110 and ADAR2 Represents a New and Important Link Between Cell Signaling and RNA Editing. (2020). DNA Cell Biol. 39(3):343-348.
Bavelloni A, Focaccia E, Piazzi M, Raffini M, Cesarini V, Tomaselli S, et al. AKT-dependent phosphorylation of the adenosine deaminases ADAR-1 and -2 inhibits deaminase activity. (2019). FASEB J. 33:9044–61.
